行业 来源:壹点网 时间:2022-07-12 15:09:10
《医疗器械监督管理条例》(国务院第739号令)在第二章第十四条“产品检验报告应当符合国务院药品监督管理部门的要求,可以是医疗器械注册申请人、备案人的自检报告,也可以是委托有资质的医疗器械检验机构出具的检验报告”。自此,医疗器械自检与委托检验在医疗器械上位法中得以明确,医疗器械检测实现了双渠道检测。
相信大家对医疗器械注册检验并不陌生,很多企业的检测人员都有在国家局认可的医疗器械检测机构进行排队等待产品检测的经历。随着医疗器械检测双渠道的开放,在一定程度上缓解了这些指定检测机构的承检压力,同时加速推动了医疗器械检测速度和检测能力的提升,尤其对于体外诊断试剂产品来说,产品基本性能检测不需要依靠大型专业设备,因此,大部分产品都可以实现医疗器械自检。那么,什么是医疗器械自检与委托检验?什么样的企业适用医疗器械注册自检呢?
为加强医疗器械注册管理,规范注册申请人注册自检工作,确保医疗器械注册检验工作有序开展,2021年10月,国家药品监督管理局发布了《医疗器械注册自检管理规定》(以下简称《自检管理规定》),并于发布之日起实施。该《自检管理规定》中,从自检能力、自检报告、委托检验、申报资料、责任等五个部分展开详述。
医疗器械注册自检的核心要素包括哪些?
医疗器械注册自检是医疗器械注册申请人按照产品技术要求,自行对其申报的产品进行全项检测,并出具自检报告,医疗器械自检工作需要纳入医疗器械质量管理体系中。对于不具备产品技术要求中部分条款项目检验能力,可以将相关条款项目委托有资质的医疗器械检测机构进行检测。关于医疗器械检验机构应当具备的资质在《医疗器械监督管理条例》第七十五条中有相关规定,在此不再赘述。
那么,此次发布的《自检管理规定》核心要素包括哪些?据从事医疗器械法规咨询10年的资深品牌迈迪思创公司分析,可以总结出四个核心要素:首先是人,自检企业应配备专职的检验人员、审核人员和批准人员,并且这些专职人员具备相应的教育背景、技术能力、经过专业培训和考核;其次是环境和设备,注册申请人应当配备满足检验方法要求的仪器设备和环境设施,建立和保存相关档案、规程和记录等;第三,样品,确保样品受控并保持相应状态;第四,合法合规,以产品技术要求为依据,公认的检验方法优先,且进行方法验证和确认。迈迪思创公司还进一步强调,企业自检的全过程要确保结果真实、准确、完整和可追溯。
哪种类型的国产企业适合医疗器械注册自检?
对于国产企业在什么情况下适合选择医疗器械注册自检路径?迈迪思创根据自己对于法规的研究与理解,建议企业建立风险评估矩阵,来分析和平衡自身的检验风险与企业能力之间的关系。该矩阵从八个维度进行综合分析,包括企业类型是成熟型企业或新成立企业;技术指标的复杂或简单程度;是否具备相应能力的人员;申报的方式是简单变更、备案,还是首次申请。迈迪思创也进行了举例说明,比如一个产品技术指标复杂的新企业计划进行首次申请,暂时没有招聘到专职的检验人员,那么,其实该企业是不适合采用自检报告的方式进行递交的,建议采用国家药监部门认可、具有资质的检测机构进行注册检验。
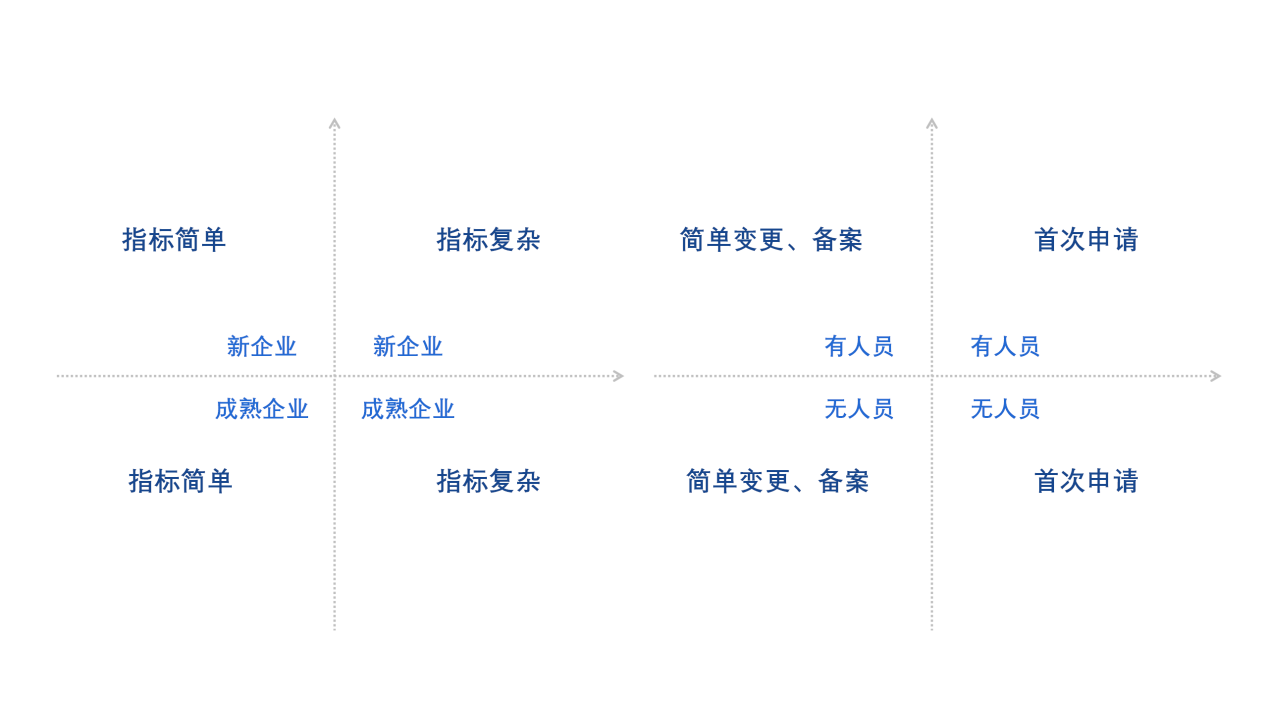
通过上述分析,让我们对医疗器械注册自检有了框架性的认识。虽然注册自检的认可使得企业在医疗器械注册、医疗器械临床试验等工作开展中有了更多的选项,但是,我们也看到医疗器械自检对企业自身的要求非常严格。在2021年召开的“第十二届中国医疗器械监督管理国际会议”上,器械审评中心的专家表示,自检是现阶段检查与管理的重点方向,但不是医疗器械检测的唯一路径,建议企业在初期做好审慎评估,再进行递交。
免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
标签: