行业 来源:今日热点网 时间:2024-09-14 17:00:39
睡眠是维持整体健康至关重要的基本生理过程,但现代生活方式导致不良或睡眠不足现象逐渐增加,进而引发各种健康问题,如代谢、认知、心血管和免疫功能障碍。解决睡眠障碍可能是预防代谢功能障碍的关键,然而,将睡眠中断与代谢障碍联系起来的分子机制仍知之甚少。2024年8月四川大学李涛等团队一篇题为“Acetate enables metabolic fitness and cognitive performance during sleep disruption”的研究论文发表在Cell Metabolism期刊上,该研究表明睡眠紊乱会导致代谢失衡和认知障碍,补充乙酸可激活丙酮酸羧化酶,从而恢复糖酵解和三羧酸循环,改善代谢失衡和认知异常。
迈维代谢为该研究提供了短链脂肪酸靶向代谢组检测!
研究方法
组学方法:短链脂肪酸靶向代谢组检测,高通量靶向代谢组学分析,16S rRNA基因测序分析,血液蛋白质组学分析等;
其他方法:ELISA,抗生素治疗,Western blotting,qRT-PCR等;
研究结果
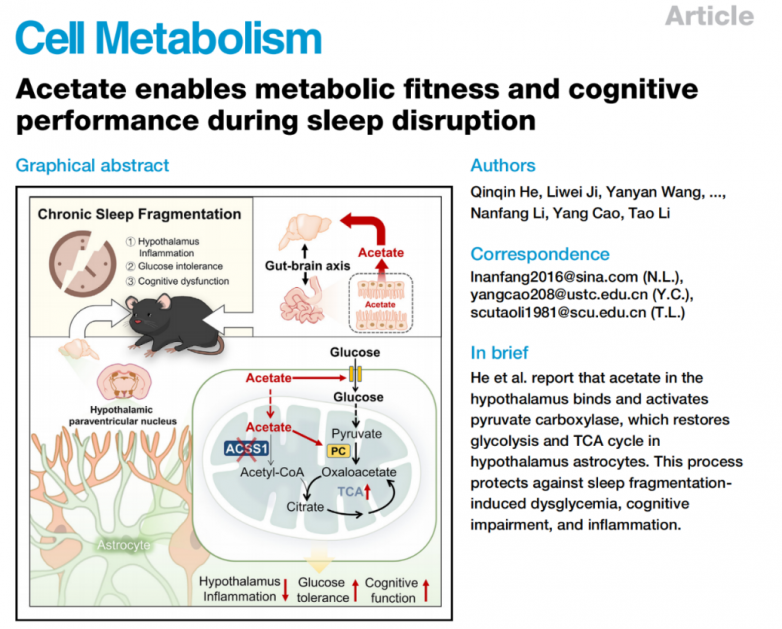
1.SF损害葡萄糖代谢和认知功能
为了研究 SF(Sleep fragmentation,碎片化睡眠,以睡眠结构紊乱为特征)对认知和代谢的影响,研究人员在成年雄性 C57BL/6J 小鼠上建立了 SF 模型(图 1A)。在光照期间,使用轨道转子诱导 SF 持续 2 周。SF 组和 CON(对照组)小鼠均可自由获取食物和水。为了评估 SF 条件下的睡眠模式,使用植入电极进行了基于脑电图(EEG)/肌电图(EMG)的睡眠/觉醒分析。与 CON 小鼠相比,SF 小鼠在光照期间觉醒时间增加。此外,光照期间非快速眼动(NREM)睡眠减少,黑暗期间快速眼动(REM)睡眠增加,但两组小鼠在 24 小时内三个睡眠-觉醒周期(觉醒、NREM、REM)的比例没有显著差异。此外,SF 小鼠在 24 小时内睡眠阶段之间的转换更频繁。这些发现表明,14 天的 SF 程序诱导了一种特征性的碎片化睡眠模式。SF 小鼠白天活动增加,而夜间活动没有改变,同时白天和夜间的食物摄入量也增加。SF 组小鼠每日食物摄入量增加,但体重没有变化,这可能是由于 SF 下能量消耗增加所致,并与先前的研究结果一致。 此外,SF 小鼠表现出明显的糖代谢紊乱,包括血糖水平升高和葡萄糖不耐受(图 1B 和 1C),以及胰岛素抵抗(图 1D 和 1E)。与葡萄糖代谢紊乱一致,SF 小鼠的认知能力受损,表现为在 Morris 水迷宫测试中目标象限内行走的距离更短、花费的时间更少、穿越次数减少,以及新物体识别能力显著下降(图 1F、1G ),雌性小鼠与雄性 SF 小鼠的变化相似。为了评估黑暗周期中 SF 的影响,从晚上 7 点到早上 7 点打开轨道转子。发现,黑暗周期中的 SF 对葡萄糖代谢、胰岛素敏感性或认知功能没有影响。
接下来,检查了这些小鼠的血浆蛋白质组,SF 导致血浆蛋白质发生显著变化,与 CON 小鼠相比,有 65 种蛋白质上调,35 种蛋白质下调(图 1H)。GO分析表明,这些蛋白质主要与葡萄糖稳态有关(图 1I),这表明 SF 破坏了小鼠的葡萄糖代谢。为了评估大脑的葡萄糖摄取量,对 CON 和 SF 小鼠的大脑进行了 18F-氟脱氧葡萄糖(FDG)正电子发射断层扫描-计算机断层扫描(PET-CT)成像。与 CON 小鼠相比,在 SF 小鼠的下丘脑中观察到 18F-FDG 的摄取量显著降低,同时在海马体或皮层中也呈现出摄取量下降的趋势(图 1J)。脑区域中由 [U-13C6] 葡萄糖衍生的 13C 的掺入情况分析发现(图 1K),与 CON 小鼠相比,SF 小鼠中[U-13C6] 葡萄糖在糖酵解和三羧酸(TCA)循环中的 13C 掺入量减少,这通过 SF 小鼠中中间产物的减少得到了证实(图 1L )。虽然 CON 和 SF 小鼠在下丘脑、海马体和皮层中糖酵解酶(己糖激酶 2 [HK2]、丙酮酸激酶 M2 [PKM2]、磷酸果糖激酶 [PFK] 和乳酸脱氢酶 A [LDHA])和葡萄糖转运体(葡萄糖转运体 [GLUT]1、GLUT3)的表达没有显著差异,但在这些脑区域中检测到了受损的胰岛素信号传导,表现为哺乳动物雷帕霉素靶蛋白(p-mTOR)和蛋白激酶 B(p-Akt)的磷酸化减少(图 1M )。总体而言,这些结果表明 SF 破坏了小鼠的葡萄糖稳态和认知功能,同时降低了相关脑区域的葡萄糖代谢。
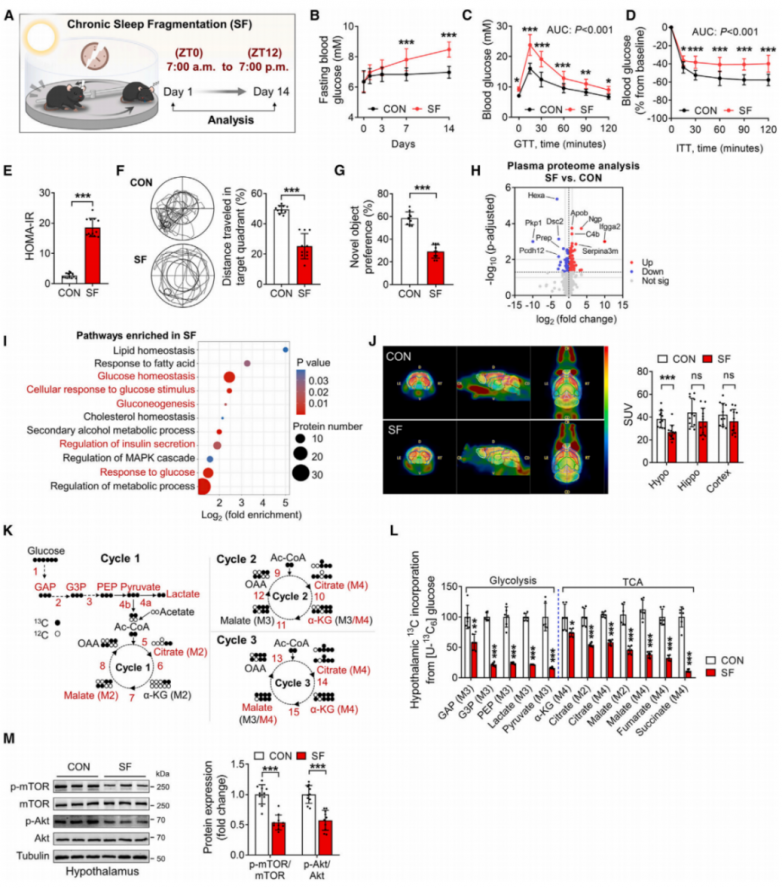
图1.SF小鼠表现出葡萄糖代谢减少和认知障碍
2.SF小鼠体内循环中的乙酸和下丘脑中的乙酸增加
为了进一步研究SF小鼠的代谢变化,对SF小鼠和CON小鼠的血浆样本进行了代谢组学分析。结果发现与CON小鼠相比,SF小鼠血浆中有39种代谢产物上调,7种下调(图2A)。值得注意的是,SF小鼠血浆中短链脂肪酸(SCFAs)的水平,包括乙酸、丙酸和丁酸,均显著增加(图2B)。在差异调控水平最大的代谢物中,与CON小鼠相比,SF小鼠血浆中的乙酸浓度逐渐升高(图2C)。乙酸主要由肠道细菌产生,研究人员检查了CON小鼠和SF小鼠的肠道菌群组成。在SF诱导后收集盲肠样本,并进行16S rRNA基因测序分析。与CON小鼠相比,SF小鼠的肠道菌群组成发生了变化。具体而言,对于产乙酸的细菌,Prevotellaceae、Dubosiella和Desulfovibrio的丰度增加,而Akkermansia、Parasutterella和Lachnospiraceae在属水平上的丰度减少(图2D)。此外,SF小鼠和CON小鼠之间的细菌群落和分类组成也存在差异。通过免疫染色检查了肠道上皮的完整性和上皮中紧密连接蛋白occludin的表达。与CON小鼠相比,SF小鼠的肠道上皮形态发生了显著损伤,表现为绒毛长度和宽度减少以及occludin蛋白表达降低(图2E-2G)。此外,SF小鼠盲肠和粪便中的乙酸水平显著降低(图2H)。这些结果表明,产乙酸菌群的增加与肠道屏障破坏之间存在潜在关联,导致SF小鼠循环中乙酸水平升高。有趣的是,乙酸水平在中枢神经系统的下丘脑中升高,但在海马体或皮层中并未升高(图2I)。进一步分析显示,NREM-觉醒转换与下丘脑和循环中的乙酸水平呈正相关,这表明SF的程度可能有助于改变乙酸水平。然后,通过碳-13核磁共振(13C-NMR)同位素分析检查了CON小鼠和SF小鼠大脑中乙酸的氧化(图2J)。结果表明,SF小鼠的乙酸氧化减少,随后的ATP产生也减少(图2K和2L)。由于乙酸氧化减少,[1,2-13C2]乙酸整合到下丘脑三羧酸循环中的13C减少(图2M和2N)。此外,酰基辅酶A(CoA)合成酶短链家族成员(ACSS)1,即线粒体中将乙酸转化为乙酰辅酶A的酶,在下丘脑中降低,但在海马体或皮层中并未降低(图2O)。在这些脑区域中,ACSS2和单羧酸转运体(MCT)水平没有显著变化(图2O)。这些结果表明,ACSS1表达的降低导致下丘脑中乙酸的积累,这可能影响葡萄糖代谢。
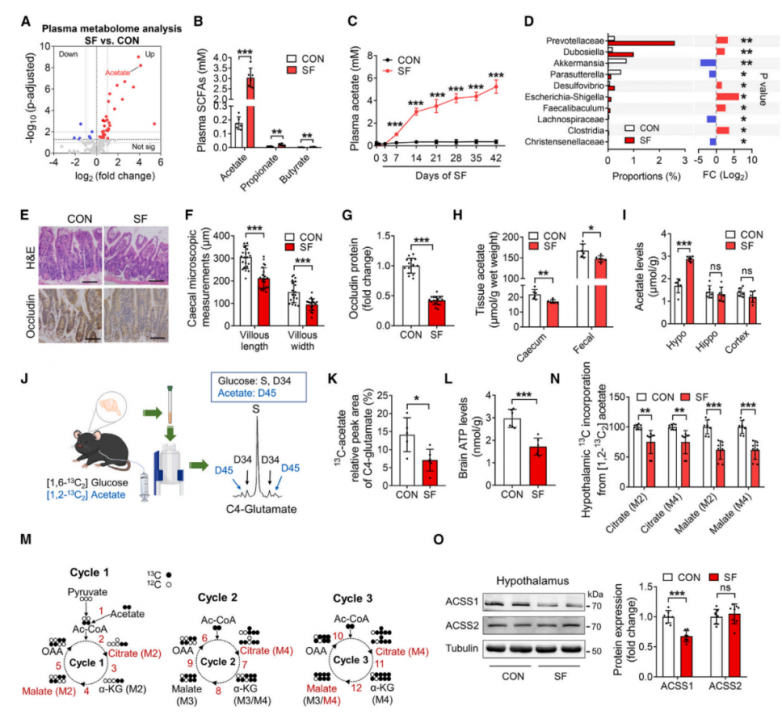
图2.SF小鼠的循环系统和下丘脑中的乙酸含量增加
3.乙酸改善了SF小鼠的血糖控制、胰岛素敏感性和认知能力
为了研究乙酸在SF中的功能作用,通过口服方式向SF小鼠(1.0 mg/g/天,每天一次)给药乙酸14天(图3A)。乙酸给药后,血浆乙酸水平在灌胃后约10分钟达到峰值。灌胃后30分钟,乙酸水平在下丘脑中显著升高,但在海马体或皮层中未升高。尽管各组之间的体重保持不变,但乙酸给药降低了SF诱导的摄食量。乙酸灌胃后,运动活性没有变化。接受乙酸补充的SF小鼠表现出改善的葡萄糖代谢,包括改善的葡萄糖耐量和胰岛素敏感性(图3B)。同样,乙酸逆转了SF引起的认知障碍,表现为目标象限中穿行距离和时间的增加以及新物体识别能力的改善(图3C、3D)。这些结果共同表明,SF期间的乙酸积累对SF小鼠的代谢功能障碍和认知障碍具有保护作用。此外,在SF期间用广谱、难吸收的口服抗生素处理成年C57BL/6J雄性小鼠,以抑制乙酸的产生(图3E)。如预期那样,抗生素治疗显著降低了下丘脑、盲肠和血浆中的乙酸水平,而乙酸输注恢复了这些水平(图3F)。虽然向CON小鼠口服广谱抗生素没有破坏葡萄糖耐量或损害认知功能和胰岛素敏感性,但用抗生素治疗的SF小鼠表现出葡萄糖代谢和认知功能障碍。这表现为葡萄糖不耐受、胰岛素抵抗、目标象限中穿行距离和时间的减少以及新物体偏好的降低(图3G-3I)。这些缺陷通过乙酸补充得到恢复,证实了肠道微生物群衍生的乙酸可保护小鼠免受SF的有害影响。
乙酸脑室内给药,直接研究其对下丘脑的影响(图3J)。与CON小鼠相比,SF小鼠的下丘脑乙酸浓度升高,并且在接受乙酸给药的小鼠中进一步升高(图3K)。重要的是,与CON小鼠相比,SF小鼠下丘脑中的炎症细胞因子和趋化因子的表达增加,而乙酸输注显著逆转了这种增加(图3L)。体重未受影响,且乙酸给药降低了SF诱导的摄食量。此外,下丘脑乙酸输注改善了SF小鼠的葡萄糖代谢、胰岛素信号传导和认知功能(图3M-3O)。一致地,下丘脑乙酸水平与胰岛素抵抗稳态模型评估(HOMA-IR)呈负相关,表明乙酸作为葡萄糖和胰岛素代谢的强效调节剂(图3P)。随后,研究人员评估了乙酸对身体成分和关键代谢激素的影响。各组之间的体重保持不变。SF显著提高了包括皮质酮和瘦素在内的激素水平,同时降低了胰高血糖素样肽-1(GLP-1)和脂联素水平。这些发现与文献中报道的SF小鼠的激素变化相一致。乙酸给药调节了SF小鼠的激素变化,以维持SF条件下的激素稳态。乙酸的中心给药复制了外周乙酸对全身激素的调节作用,表明乙酸对SF小鼠激素稳态的影响可以在中枢系统中模拟。此外,无论是外周还是中枢给予乙酸,均增加了SF小鼠的GLP-1水平。通过GLP-1受体拮抗剂实验表明乙酸对SF小鼠葡萄糖稳态和认知功能的影响与GLP-1无关。
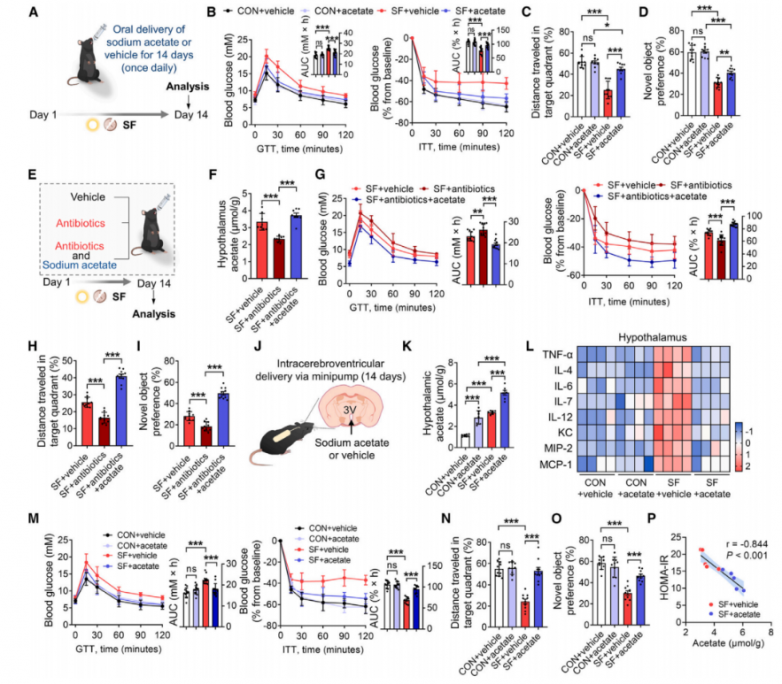
图3.在SF小鼠模型中乙酸输注可改善血糖控制、胰岛素敏感性和认知功能
4.Acss1基因缺失逆转了SF诱导的代谢和认知功能障碍
乙酸在线粒体中被ACSS1转化为乙酰辅酶A(图4A)。中枢神经系统中的Acss1表达仅见于神经胶质细胞,其中星形胶质细胞表达水平最高。接下来,测试了通过抑制Acss1来抑制乙酸利用是否会影响乙酸水平及其在SF中的后续功能作用。利用特异性敲除星形胶质细胞Acss1(条件性敲除[cKO])的小鼠,这些小鼠是通过删除小鼠Acss1基因的4-5号外显子而产生的。野生型(WT)和cKO小鼠均接受14天的SF处理。免疫荧光分析证实,Acss1 cKO小鼠星形胶质细胞中的Acss1被耗尽(图4B)。值得注意的是,Acss1 cKO增强了大脑中乙酸的积累(图4C),而循环中的乙酸水平保持不变。在14天的SF诱导后,与WT小鼠相比,cKO小鼠的每日食物摄入量减少,但两组之间的体重相当。与WT小鼠相比,Acss1 cKO逆转了SF小鼠的代谢缺陷,包括改善葡萄糖耐量、胰岛素敏感性和降低HOMA-IR(图4D)。此外,cKO显著改善了SF后下丘脑、海马体和皮层的胰岛素信号传导,表现为p-mTOR和p-Akt水平升高,这表明乙酸在局部葡萄糖稳态中起着关键作用。与血糖控制改善相一致,cKO小鼠的认知能力也有所改善,表现为在目标象限中行走的距离和时间增加,以及新物体识别能力增强(图4E、4F)。在正常条件下,WT和Acss1 cKO小鼠之间的血浆乙酸水平、葡萄糖代谢和认知能力没有差异。
SF激活的星形胶质细胞主要位于下丘脑的室旁核(PVN)(图4G),并且SF导致PVN内星形胶质细胞中的ACSS1表达大约减少了50%。然后,研究人员试图通过向PVN立体定向注射腺相关病毒(AAV)9-胶质纤维酸性蛋白(GFAP)-shAcss1来特异性地抑制星形胶质细胞中的Acss1(图4H)。与对照(CON)组相比,Acss1短发夹RNA(shRNA)显著降低了星形胶质细胞中的Acss1 mRNA和蛋白水平(图4I),导致下丘脑乙酸积累。与Acss1 cKO小鼠观察到的表型相似,Acss1敲低减轻了SF引起的代谢功能障碍和认知障碍(图4J–4L),并且在将SF时间延长至28天时,这种保护作用仍然存在。值得注意的是,通过AAV9-GFAP-shAcss1靶向下丘脑PVN的乙酸代谢干扰始终导致海马体和皮层葡萄糖代谢增强,这表明仅调节PVN中的乙酸水平就足以调节远程脑区域的葡萄糖代谢。这些发现共同表明,PVN中的乙酸积累对SF的有害影响具有保护作用。
通过AAV1顺行追踪实验和膜片钳实验(图4M–4O)发现调节PVN星形胶质细胞中的乙酸代谢可以影响SF引起的认知变化。在下丘脑PVN星形胶质细胞中过表达Acss1(Acss1OE)来调节乙酸水平,在14天SF期间,Acss1OE对体重或食物摄入量没有影响。然而,它有效地消除了下丘脑中乙酸随时间积累的现象。因此,与对照组相比,在SF的第3天和第7天,Acss1OE小鼠的葡萄糖异常和认知障碍加剧,这表明在SF的早期阶段增加乙酸可能具有潜在的有益作用。将携带shAcss1的AAV9与针对这些细胞类型的特定启动子一起注入PVN。在SF条件下,与对照组相比,接受此干预的小鼠在葡萄糖代谢和认知方面没有显著改善。这表明星形胶质细胞中的Acss1敲低是调节SF引起的葡萄糖代谢和认知障碍的主要细胞机制。综上所述,这些发现共同表明,PVN中的乙酸积累是一种适应性反应,对SF的不良影响具有保护作用。
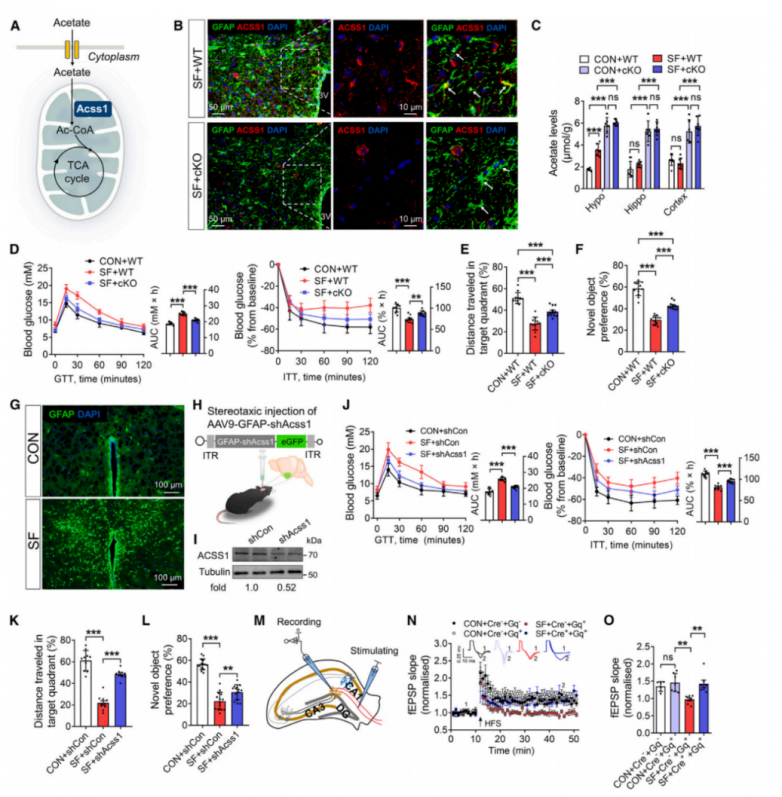
图4.Acss1 缺失可逆转 SF 诱导的代谢和认知功能障碍
5.乙酸激活丙酮酸羧化酶促进SF小鼠下丘脑的糖酵解和三羧酸循环
在星形胶质细胞中,葡萄糖主要通过GLUT1被摄取。随后,葡萄糖可通过糖酵解途径中的第一个限速酶HK2转化为葡萄糖-6-磷酸(G-6-P)。由葡萄糖衍生的丙酮酸可进一步通过丙酮酸脱氢酶(PDH)转化为乙酰辅酶A,或被丙酮酸羧化酶(PC)催化为草酰乙酸(图5A)。为了了解乙酸在下丘脑星形胶质细胞中的代谢调节机制,从野生型(WT)小鼠的下丘脑中分离出原代星形胶质细胞,并在乙酸存在的情况下用同位素标记的葡萄糖([U-13C6]葡萄糖)处理这些细胞。乙酸以剂量依赖的方式增加了[U-13C6]葡萄糖的摄取,表明乙酸增强了星形胶质细胞对葡萄糖的摄取(图5B)。值得注意的是,这种作用与胰岛素无关,但可被GLUT1的特异性抑制剂WZB117阻断(图5C)。这些结果表明,乙酸诱导的葡萄糖摄取至少部分是通过GLUT1介导的。此外,乙酸处理还提高了原代下丘脑星形胶质细胞的糖酵解能力,这通过细胞外酸化速率的增加来证明(图5D)。与乙酸处理的效果一致,使用慢病毒shRNA敲低Acss1也增加了下丘脑星形胶质细胞对[U-13C6]葡萄糖的摄取。然而,并未在原代星形胶质细胞中观察到GLUT1、HK2、PC、PDH的蛋白质表达或GLUT1的膜表达发生显著变化。同样,在SF状态下,cKO小鼠和WT小鼠的下丘脑中,这些蛋白质的表达也未见显著差异。这些发现表明,乙酸对星形胶质细胞中葡萄糖代谢的影响并非通过改变这些关键代谢酶的表达水平来介导。有趣的是,在原代星形胶质细胞中,乙酸处理增加了PC、PDH和HK的活性,其中PC对乙酸暴露的反应活性最高(图5E)。同样,与对照(CON)小鼠相比,在SF状态下,cKO和WT小鼠的下丘脑中PC活性也增加。这些结果表明,乙酸可能调节星形胶质细胞中参与葡萄糖代谢的关键酶的活性,特别是PC的活性。
接下来,使用13C标记的葡萄糖评估了原代星形胶质细胞内葡萄糖的代谢情况(图5F)。在乙酸处理后,计算了通过丙酮酸羧化酶(PC,蓝色点)和丙酮酸脱氢酶(PDH,红色点)将13C掺入三羧酸(TCA)循环中间产物的比例(图5F)。与载体组相比,乙酸处理提高了原代下丘脑星形胶质细胞中PC/PDH的比率,表明乙酸增强了PC在葡萄糖代谢中的贡献(图5G)。为了进一步研究PC和PDH的作用,使用慢病毒递送短发夹RNA(shRNA)敲低了星形胶质细胞中PC和PDH的表达。乙酸处理增加了葡萄糖的摄取及其掺入TCA循环中间产物的量(图5H)。这些变化被PC的敲低所阻断,而PDH的敲低则无此效果,表明乙酸诱导的葡萄糖代谢主要由PC介导(图5H)。此外,通过U-13C谷氨酸标记实验发现乙酸对星形胶质细胞谷氨酸代谢的影响微乎其微。
研究人员对完整的人PC结构模型进行了混合溶剂分子动力学(MixMD)模拟,并通过计算确定了乙酸在PC上的潜在结合位点(图5I)。确定了三个乙酸结合的高占用热点,分别标记为位点I、II和III(图5I)。位点I位于链C的CT域,位点II和III分别位于链B和C的CT域(图5I)。根据计算出的自由能,位点III被预测为最有利的结合位点。为了探索这些结合位点是否介导PC活性,研究人员构建了带有血凝素(HA)标签的PC的一系列缺失突变体。结果表明,包含782–831aa氨基酸的PC区域对PC活性至关重要,这是通过PC活性测定检测到的(图5J)。这表明PC蛋白的这一特定区域负责其激活,并且其存在对于乙酸在星形胶质细胞中对糖酵解和三羧酸(TCA)循环的影响是必要的。
为了检查PC是否介导乙酸在SF小鼠中的认知和代谢功能,使用GFAPAAV9在Acss1 cKO小鼠的PVN中的星形胶质细胞内敲低了PC。AAV9-shPC注射3周后,下丘脑中的PC蛋白表达降低了约50%。在SF诱导后,Acss1 cKO小鼠下丘脑中的PC活性在AAV9-shPC注射后降低。此外,Acss1 cKO小鼠下丘脑中的18F-FDG摄取增加,而PC敲低则逆转了这一现象(图5K)。一致地,与SF下的cKO小鼠相比,PC敲低损害了葡萄糖代谢、胰岛素敏感性和认知表现(图5L–5N)。PC敲低还逆转了cKO小鼠中的激素变化以及p-Akt、p-mTOR、肿瘤坏死因子α(TNF-α)和白细胞介素-6(IL-6)的表达(图5O,5P)。这些发现与在高糖处理的原代下丘脑星形胶质细胞中PC敲低的观察结果一致。尽管己糖激酶2(HK2)在糖酵解中起关键作用,并且可能被乙酸激活(图5E),但HK2在PVN区域星形胶质细胞中的特异性过表达并未影响SF小鼠的认知功能或葡萄糖稳态。综上所述,这些发现表明乙酸与PC之间的相互作用调节了SF小鼠的葡萄糖稳态和认知表现。
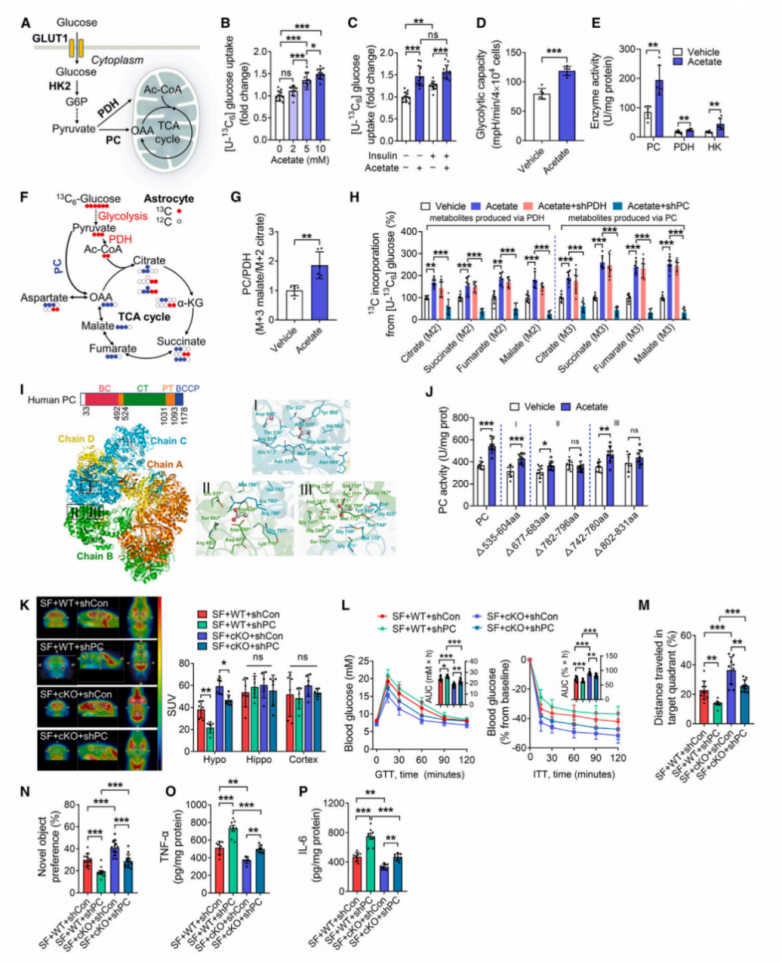
图5.在 SF小鼠中乙酸通过增加糖酵解来补充三羧酸循环
6.乙酸对葡萄糖代谢受损小鼠的治疗效果以及乙酸与人类群体葡萄糖稳态之间关联的证据
在蔗糖异构酶缺乏症患者中已发现血液乙酸水平升高,这与更健康的代谢状况相关,包括较低的体重指数、减少的脂肪百分比和更低的空腹甘油三酯水平。 同时,2型糖尿病(T2D)患者的乙酸水平趋于升高,但其代谢影响仍不清楚。为了检验乙酸在代谢和认知功能障碍发生后是否仍有益处,研究人员在雄性C57BL/6J小鼠中诱导了SF,并额外给予口服乙酸14天(图6A)。在SF小鼠中,乙酸灌胃后约10分钟,血浆乙酸水平达到峰值,且灌胃后30分钟,乙酸水平在下丘脑中显著增加,但在海马体或皮层中则没有。乙酸输注改善了SF小鼠的葡萄糖稳态和认知功能(图6B-6D)。这些结果表明,乙酸可能作为与代谢和认知障碍相关的睡眠-觉醒障碍的一种治疗手段。除了SF外,乙酸还改善了高脂饮食(HFD)治疗的肥胖小鼠和db/db糖尿病小鼠的葡萄糖代谢和胰岛素敏感性。为了研究乙酸与人类葡萄糖稳态之间的相互作用,选择了被诊断为阻塞性睡眠呼吸暂停(OSA)的患者,这是一个通常与SF相关的人群。共招募了25名健康对照(CON)个体、25名仅患OSA的患者和25名同时患有OSA和T2D的患者,并进行了血浆短链脂肪酸(SCFAs)靶向代谢组学检测分析。值得注意的是,与CON受试者相比,OSA和T2D患者的血浆乙酸水平显著升高,而其他SCFAs则保持不变(图6E)。这些发现与小鼠中的先前观察结果一致,并进一步强调了乙酸与人类葡萄糖稳态之间的关联。通过公共数据(GWAS)基因关联分析发现乙酸与血糖相关表型(包括空腹血糖、空腹血胰岛素、HOMA-IR和T2D)之间存在负遗传相关性(图6F)。
为了进一步确认乙酸在下丘脑中的功能,研究人员从基因型-组织表达(GTEx)项目的注释中确定了五个具有生产力的下丘脑表达数量性状基因座(eQTLs)-单核苷酸多态性(SNPs),它们与下丘脑中的Acss1表达相关。接下来,使用METAL对五个显著SNPs的Acss1-eQTLs进行基因分型,以关联从GWAS汇总中检索到的先前GWAS研究中的信号,然后观察到与睡眠和葡萄糖代谢相关的特征之间存在显著相关性(p<0.0001)(图6G)。这些遗传数据表明,Acss1变异不仅与睡眠有关,还与葡萄糖稳态有关,这意味着在人类中调节由Acss1支持的乙酸代谢在睡眠障碍和葡萄糖代谢受损方面可能会带来相当大的健康益处。
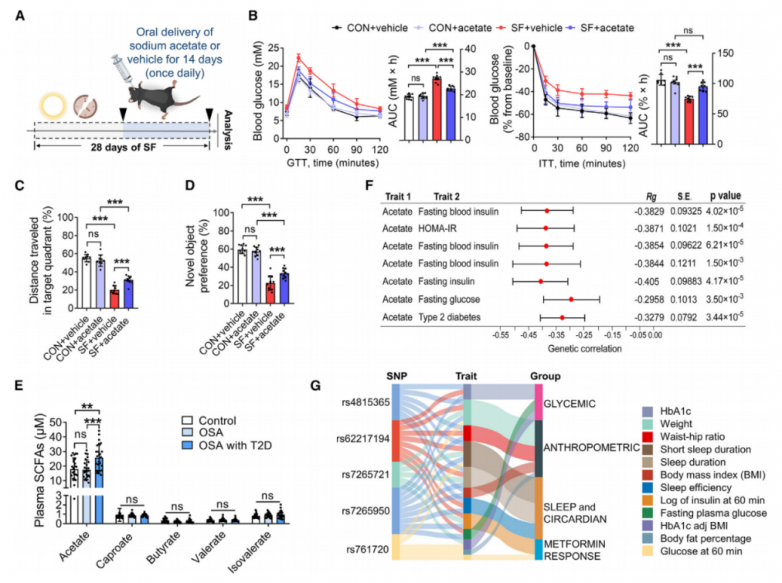
图6.乙酸改善小鼠的葡萄糖代谢,以及乙酸与人体葡萄糖稳态之间关联的证据
研究亮点
1.慢性碎片化睡眠(SF)影响小鼠的葡萄糖代谢和认知功能;
2.下丘脑中的乙酸水平会适应性地升高以应对SF;
3.乙酸可减轻SF小鼠的糖代谢紊乱、认知障碍和炎症;
4.乙酸结合并激活丙酮酸羧化酶,以恢复下丘脑星形胶质细胞中的糖酵解;
总之,下丘脑中的乙酸结合并激活丙酮酸羧化酶,从而恢复下丘脑星形胶质细胞中的糖酵解和三羧酸循环。这一过程可防止由SF引起的糖代谢紊乱、认知障碍和炎症。
迈维代谢提供靶向检测研究方案,通过精准的靶向检测和个性化的分析服务,支持科学研究并推动临床转化,促进健康管理和疾病治疗。


免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
标签:
上一篇:和MONA M03一样好!
下一篇:最后一页