行业 来源:今日热点网 时间:2024-08-01 17:08:28


西瓜(Citrullus lanatus (Thunb.) Matsum. & Nakai)是世界各地种植的重要经济作物。栽培西瓜,即使是从不同的地理区域采集的,通常也表现出较低的遗传多样性。西瓜基因库中重要性状遗传多样性的缺乏已经成为阻碍西瓜改良的瓶颈,并导致人们将注意力转向西瓜作物野生近缘(CWRs)遗传变异的表征和利用。除了C. lanatus, Citrullus amarus和Citrullus mucosospermus外,西瓜属还包括6个额外的物种,它们是半野生的,在当地收获其可食用的果肉或种子,而其余的西瓜属物种表现出独特的适应性状,这对遗传增强和理解西瓜进化至关重要。
2024年7月8日,nature genetics在线发表了北京大学现代农业科学研究院题为“Telomere-to-telomere Citrullus super-pangenome provides direction for watermelon breeding”研究结果,研究利用T2T基因组、转录组、代谢组技术手段,建立了西瓜的泛基因组,同时基于基因分析结合代谢组学结果,对于西瓜苦味、甜味、色泽、种子大小、果实成熟等各个性状进行驯化分析。

研究结论:
1.获得27个代表性品种的T2T基因组,结合G42基因组信息,构建西瓜属的泛基因组,本研究构建的泛基因组是封闭类型的;
2.核心基因和非必须基因在基因组和物种的分析表明西瓜基因组具有高度可塑性;
3.SV变异分析表明栽培西瓜的遗传多样性很窄,野生西瓜的遗传多样性更大;
4.西瓜进化分析表明在栽培西瓜的谱系中,除了cordophanus之外,还可能存在其他祖先。
5.驯化过程中的基因分析表明西瓜中与糖和颜色相关的基因存在同步驯化,苦味、糖、色泽相关的基因表达量与相对应的物质含量直接相关。
研究结果
1.来自7个属的27个不同品种西瓜的T2T基因组装
为了创建一个代表整个西瓜属遗传多样性和基因组结构的超级泛基因组,根据429个品种的系统发育关系和地理分布,战略性地选择了27个具有代表性的品种(图1a-c),包括一个具有T2T无间隙基因组的品种(图1d)。该组包含所有7个瓜属,27个材料的表型高度多样化(除各种属的代表性品种外,还收录了一些抗病品种)。
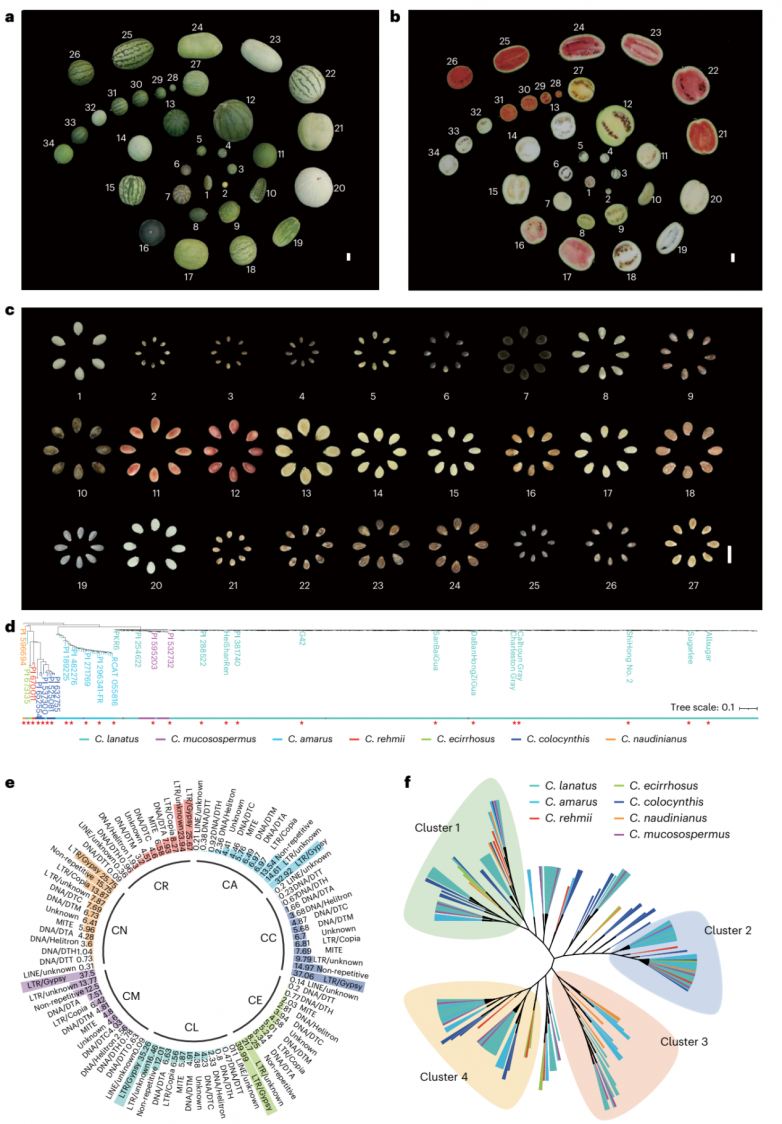
图1.西瓜遗传多样性和表型
对每个品种的基因组进行重新组装,最终获得了27个具有代表性的T2T基因组,Circos和点阵图所示,新组装的基因组与先前发布的G42基因组表现出良好的共线性。最终组装的基因组大小在361.3 Mb到413.6 Mb之间,平均为375.2 Mb。此外同时组装了27个西瓜材料的叶绿体和线粒体基因组,它们的平均长度分别为156.9 kb和622.2 kb。为了进行基因注释,对西瓜不同发育阶段的多个组织进行了RNA测序,平均每个基因组预测了24,698个蛋白质编码基因。总之,这些全面的泛基因组组装和伴随的基因资源为西瓜生物学和育种工作中全基因组基因库的进一步探索和利用提供了坚实的基础。
2.西瓜超泛基因组的构建与分析
为了探索该家族的基因组景观,基于28个品种的存在-缺失变异(PAV)建立的系统发育树接近于先前使用单核苷酸多态性(SNP)对西瓜属进行的分类。通过观察每次添加新基因组时泛基因组、核心基因组和必要基因组基因数量的变化来估计入选的代表性(图2a)。模拟分析随机化西瓜品种的顺序表明,本研究构建的泛基因组是封闭的(图2a)。28份材料的泛基因组大小约为单个基因组的1.5倍,相对于栽培西瓜增加了11225个基因家族。与其他的研究相比,该全基因组新增了8,736个基因家族,其中4,913个基因家族来自C. rehmii, C. ecirrhosus和C. naudinianus物种。
总体而言,每个基因组中平均有42.78%核心基因、8.80%软核心基因、45.87%非必须基因和2.55%特有基因(图2b)。非必须基因和特有基因是物种间表型多样化的主要原因。核心基因和非必须基因在基因组(图2c,d)和物种之间的存在-缺失分布导致基因PAV差异高达40%左右,表明西瓜基因组具有高度可塑性。
共有96.3%的核心基因和88.0%的软核心基因含有带注释的InterPro结构域,显著高于非必须基因(55.6%)和特有基因(32.4%)。核心基因的平均表达水平明显高于非必须基因和特有基因。核心基因的核苷酸多样性(π)低于非必须基因。这些结果共同支持了核心基因参与基本生物过程的前提,非必须基因表现出更大的遗传变异,可能在环境适应中发挥作用,而特有基因可能在决定个体物种形态特征方面发挥重要作用。
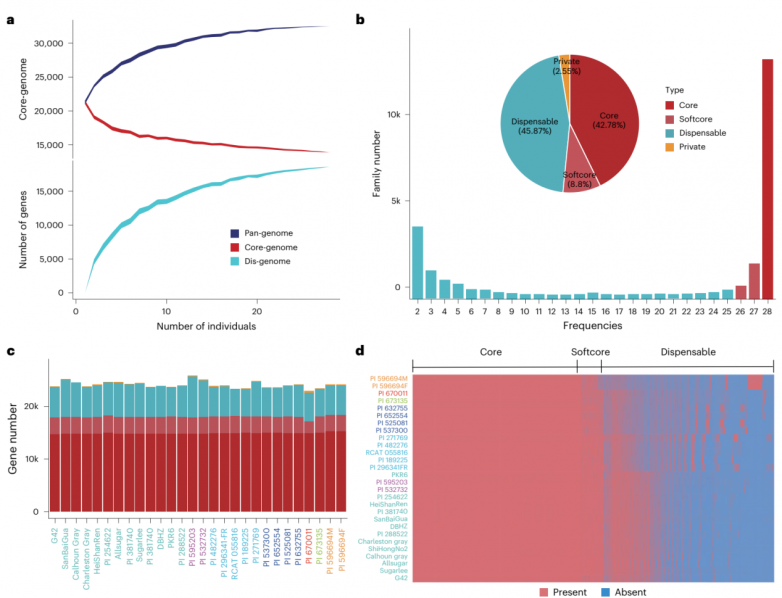
图2.28份西瓜材料的全基因组和核心基因组分析
3.SV鉴定和基于图谱的基因组
与SNPs相比,SV对基因组多态性和功能基因变异的影响更大。通过将27个新基因组与G42参考基因组比对,将>20 bp的SV分为缺失、插入、重复、倒位和易位5类。所有461,987个非冗余SVs包括217,076个(46.99%)缺失,239,698个(51.88%)插入,3,122个(0.67%)重复,1,278个(0.28%)倒位和813个(0.18%)易位(图3a)。当这些数据与G42进行比较时,平均鉴定出81,132个SV(范围从6,390到217,199)。这些SV平均影响150 Mb的基因组序列(范围从9.93 Mb到364.5 Mb)。为了验证SV鉴定的准确性,对57个平均长度为26418 bp的大SV进行PCR扩增验证,其中包括31个缺失和26个插入。通过绘制所有组合变异及其与参考基因组的共线性,建立了一个全面的SV图谱。这一图谱揭示了栽培西瓜的遗传多样性很窄,但野生西瓜的遗传多样性明显更大(图3b)。
西瓜中的SV往往富集于重复DNA区域以及缺失和插入类型(图3c,d),这一模式与之前对大豆的研究一致。分析发现平均27.5%的SVs与基因的上游或下游2 kbp区域重叠。平均7.5%的SV引起了氨基酸编码的变化,这可能有助于基因功能的多样性(图3e)。这些发现表明,在栽培西瓜及其近缘种的进化过程中,超泛基因组中的SV反映了较大的结构变化,可以加深对瓜类进化的基因组和表型变化的认识。
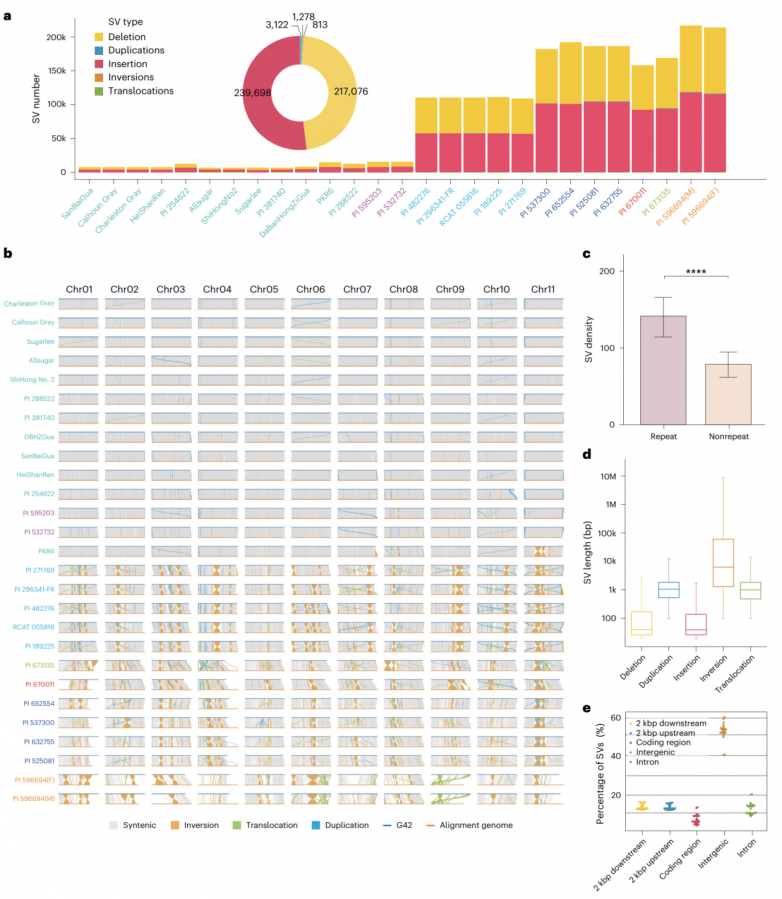
图3.西瓜28个基因组的遗传SVs分布情况
4.西瓜的物种分化和起源
染色体重排对理解适应和物种形成具有重要意义,因为它们在相关物种之间形成了基因流动的障碍。鉴定并验证了西瓜属种间三种主要的染色体重排(图4a,b),与其他三种瓜类(C. lanatus, C. mucosospermus和C. amarus)相比,在C. colocynthis中发现了涉及chr01和chr04的染色体间重排。这些染色体结构的改变可能会导致生殖隔离,影响杂种育性,减少种间重组,最终导致瓜类分化。为了研究西瓜三维基因组在不同物种间的保存和变异,利用50 kb分辨率的矩阵对A和B区室进行了鉴定。结果表明,A和B隔室在西瓜物种中相对保守。据报道,A区室和B区室的变异与基因组SVs密切相关。在不同类型的SV中观察到4.5 Mb倒置的变化,导致A和B室的变化。
以前的报道认为西瓜的祖先可能是C. lanatus subsp. cordophanus,产于非洲东北部苏丹的一种野生西瓜。分析发现野生西瓜(C. amarus)和栽培西瓜(C. lanatus)之间的SVs呈爆炸性增长。相比之下,C. mucosospermus与栽培西瓜的SVs无显著差异(图3a)。在C. lanatus共鉴定出362个SV,其中33个遗传自C. mucosospermus,68个遗传自 C. lanatus subsp. Cordophanus,有200个在C. mucosospermus和C. lanatus subsp. Cordophanus之间共有(图4c)。
在基因组图谱上显示栽培西瓜基因组及其两个可能的祖先中的大片段倒位(图4e)。在C. lanatus中检测到的倒位是从C. lanatus subsp. Cordophanus和C. mucosospermus中继承来的。在C. lanatus中识别的一些结构变异(SVs)不仅从C. lanatus subsp. Cordophanus继承,还从C. mucosospermus继承,这表明在栽培西瓜的谱系中,除了cordophanus之外,还可能存在其他祖先。
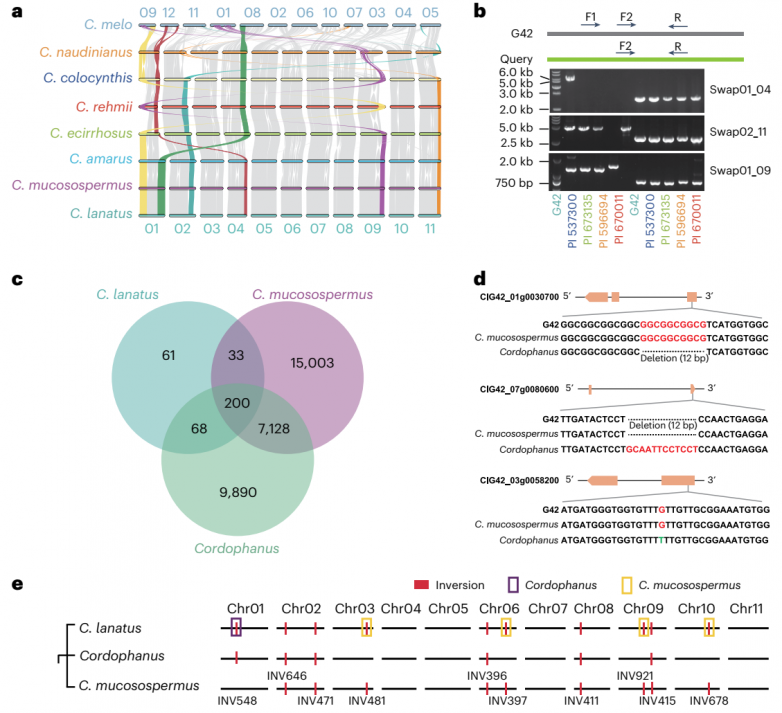
图4.西瓜品种的分化和驯化西瓜的起源
5.西瓜驯化过程中基因的得失
在西瓜驯化过程中,基因的获得和损失有助于使与抗病、糖积累和果肉着色相关的基因多样化。利用单拷贝同源基因对各种西瓜属和相关葫芦物种进行比较分析,揭示了它们的分化时间,C. naudinianus大约在1675万年前(Mya)分化,而C. lanatus和C. mucosospermus最近的分化事件发生在0.76 Mya左右(图5a)。值得注意的是,在西瓜进化和驯化过程中,丢失的基因多于获得的基因(图5a),这说明在驯化过程中存在一些基因变化。
PKR6是由种间杂交而成的多抗病自交系,PKR6的基因组图谱信息如图5c所示。在1号染色体的5cm区域发现了一个QTL qfon1.1具有对Fon 1小种的抗性。将PKR6基因组QTL区域序列与易感品系G42的基因组进行比对,将QTL缩小到一个小区域(364 kb)。PKR6对Fon2小种的高抗性(图5d)使其成为比CWRs更好的选择,用于对优质西瓜的渐渗抗性。PKR6的发展表明,利用现有的基因组信息,可以有目的地将丢失的抗性基因整合到精英系中。今后的工作重点可能是将C. naudinianus、C. ecirrhosus和C. rehmii的抗性基因导入到优良西瓜品系中。
栽培西瓜最显著的收获是甜度和果肉颜色。拷贝数变异(CNV)分析显示,TST2基因(ClG42_02g0107100、ClG42_02g0107200)扩增导致糖积累,LCYB基因(ClG42_04g0042900)碱基改变导致西瓜果肉着色(图5e、f)。分析还表明,TST2与LCYB- GG的重复拷贝与TST2与LCYB- TA的单拷贝之间存在很强的相关性(P = 3.5 × 10−5)(图5),表明TST2和LCYB在西瓜驯化过程中同时被驯化。此外,高水平表达的色质体磷酸盐转运体ClPHT4;2 (ClG42_10g0214700)被发现是果肉着色所必需的,与野生西瓜相比,栽培西瓜的糖和植物激素信号介导ClPHT4;2转录的模式不同。这表明TST2基因的拷贝数可能是调节糖信号通路的阈值开关,从而调控ClPHT4;2的表达,导致西瓜糖积累和果实着色的共选择。重新引入失去的抗性基因、了解糖积累和果肉颜色的共同进化对有效的西瓜育种计划至关重要。
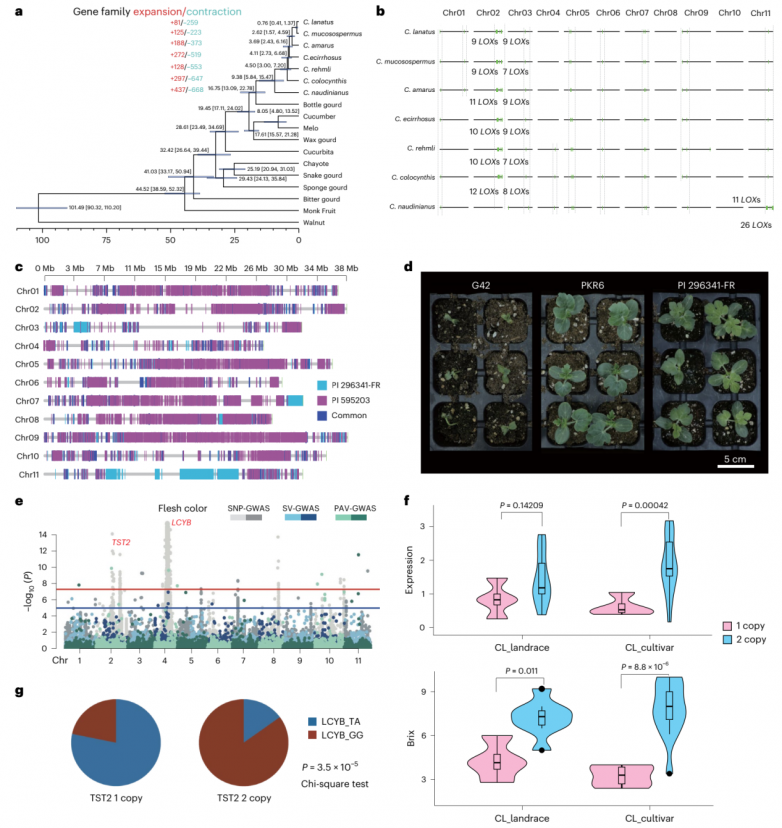
图5.西瓜驯化过程中的基因扩增和收缩分析
6.SV基因在进化和驯化中的作用
据报道,选择影响了西瓜果实的一系列农艺性状,包括苦味、含糖量、果肉颜色、形状、成熟度和种子大小。为了研究与这些性状相关的基因是否受到环境和/或人类选择的影响,对C.colocynthis、C. amarus、C. mucosospermus和C. lanatus的启动子和CDS中的SVs进行了扫描。结果发现,功能基因的SVs在C.colocynthis和C.amarus中存在,而在C.mucosospermus和C.lanatus中不存在,这表明这些SVs可能在物种形成和驯化过程中被选择了。SVs在功能基因中通常位于启动密码子的上游,一些位于编码区(图6)。分析发现基因表达可能是受SV影响,然后导致一个或多个农艺性状变化,此外果实甜度、苦味和果肉颜色相关基因的SVs与不同品种果实的表达模式一致(图6)。
西瓜果实的一个重要性状驯化是失去苦味。如前所述,从西瓜中分离出的主要苦味化合物是CuE,据报道,CuE存在于野生西瓜的根和果实中,而只存在于栽培西瓜的根中。在西瓜属植物中,CuE的合成受到组织特异性调节因子的差异控制。虽然有报道称ClBt (ClG42_01g0033300)是一种果实特异性葫芦素调节剂,可以在西瓜果实中启动CuE生物合成途径的第一步,但它在叶片中的表达似乎高于果实,在大多数品种的果实样品中几乎为零表达。此外,在C. colocynthis和C. amarus中分别鉴定出位于ClBt起始密码子上游941 bp和247 bp的6 bp和18 bp缺失(图6)。除此之外,Cl890B (ClG42_01g0153000)、Cl170 (ClG42_06g0015500)、Cl180 (ClG42_06g0015600)和ClACT (ClG42_06g0015800)也参与CuE的生物合成途径,ClMATE1 (ClG42_01g0153300)与CuE在西瓜中的转运有关。在C.colocynthis的启动子区或CDS区检测到SVs,在C. amarus中检测到的SVs较少。这5种苦味基因的表达量在C.colocynthis中最高,在C. amaru中急剧下降,在C. mucosospermus和C. lanatus中几乎不表达,表达水平与CuE含量呈正相关(图6)。
与葫芦素含量降低相反,栽培西瓜果肉中的糖和色素积累较多。TST2的CNV和ClSWEET3 (ClG42_01g0006000) 、ClVST1 (ClG42_02g0044600) 、ClNAC68 (ClG42_03g0079100) 和ClAGA2 (ClG42_04g0035700)的SV在远亲种C.colocynthis和C.amarus中出现,远亲种C. mucosospermus和驯化的C. lanatus中没有检测到(图6)。上述基因在地方品种的果实中表达较少,在C. colocynthis、C. amarus和C. mucosospermus的果实中几乎检测不到。ClbZIP1和ClbZIP2两个转录因子感知到糖含量升高,结合到ClPHT4;2启动子区域的ABA -responsive element (ABRE) motif上,ClPHT4;2被上调,导致西瓜品种中类胡萝卜素积。C. colocynthis和C. amarus的ClPHT4;2的CDS区分别有6 bp和12 bp的缺失(图6)。果肉颜色与基因表达呈正相关,ClNCED1 (ClG42_01g0254100) 和ClNCED7 (ClG42_07g0105300) 也是如此(图6)。
与驯化过程中苦味、含糖量和果肉颜色或减少或增加不同,不同品种间果实形状、种子大小和果实成熟的表型存在差异。在驯化过程中,果实形状由小到大再到略小,种子大小也有变化(图1a-c)。尽管已被报道的基因表达模式与果实形状和种子大小性状相关,但它们与SV的外观并不一致(图6)。两种果实成熟相关基因的SVs均存在,但在四种中表达不一致(图6)。驯化的过程是复杂的,SV只是影响瓜类间变异的因素之一。
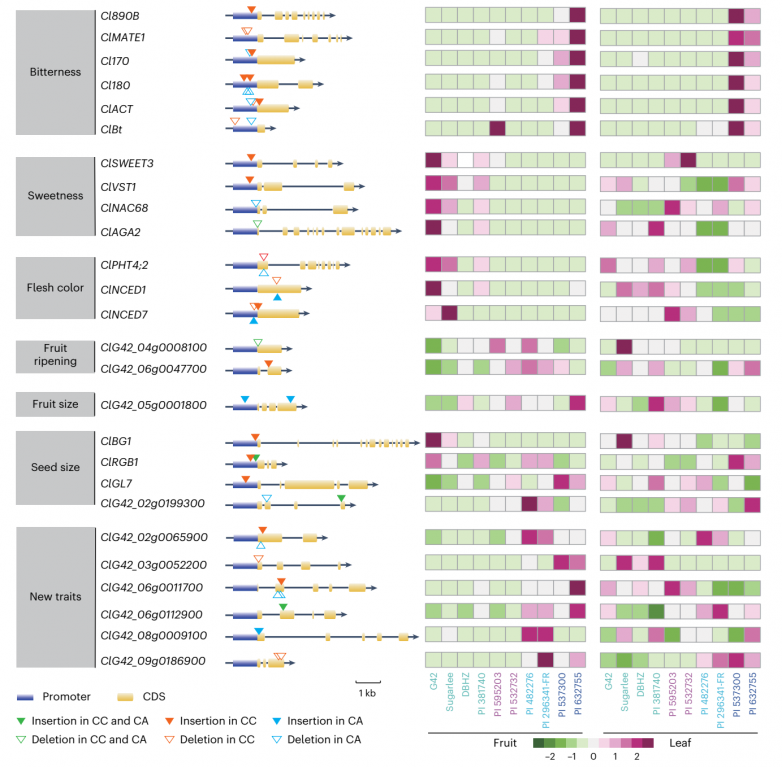
研究思考
本研究最终通过构建27个代表性品种西瓜的泛基因组数据,从中获取得到西瓜苦味物质、甜味、色泽、抗病的驯化与基因组SV变异相关,而种子大小、果实形状、果实成熟度则与SV关联性较小,这些结果都可以为西瓜育种提供高效的筛选思路。在研究中同样引入代谢组学技术手段对与苦味物质、甜味、色泽等性状相关的代谢物进行检测,这些物质与基因的表达直接相关,这也表明在育种过程中很多性状的表现最终都是通过物质积累或减少来达到的,因此在育种中引入代谢组学技术,不失为一种高效的辅助手段。
与国内专家们的研究脚步保持一致,我们也步履不停,在2024年上半年我们已经完成了植物广泛靶向®代谢组产品的升级,本次升级主要包括3个方面:
1.数据库升级:本次升级主要增加的为次生代谢物,数据库目前包含35000+物质,其中33000+种均为次生代谢物;
2.检出升级:检出有了显著的提升,目前植物广泛靶向®代谢组的最高检出可以达到4000个物质,Level1平均可以达到600+,最高可到900+;
3.分析升级:MetMapTM的分析已经升级到V2.0版本,包含有60条代谢通路,相较于V1.2版本新增30条通路,通路覆盖黄酮、萜类、生物碱、香豆素等次生物质通路,升级后的MetMap通路为KEGG扩展了2800+种新物质;
欢迎老师们咨询~




免责声明:市场有风险,选择需谨慎!此文仅供参考,不作买卖依据。
标签:
上一篇:宁波阪急热魂游戏厅2.0盛大启幕,与巴黎奥运会共绘夏日激情画卷
下一篇:最后一页